
蛋白質乳酸化的發現
長期以來,乳酸(lactate)被視為細胞代謝中的“廢棄物”。在經典代謝路徑中,細胞在缺氧或高強度代謝狀態下會啟動糖酵解,快速將葡萄糖轉化為丙酮酸。由于缺乏氧氣,丙酮酸無法進入線粒體的三羧酸循環,而是被還原為乳酸,以再生NAD?供糖酵解持續進行。這一過程雖然維持了能量供應,卻也導致乳酸大量積累,因此乳酸長期被貼上“無氧代謝副產物”的標簽,被認為需要通過轉運或肝臟代謝清除以維持內環境穩定。
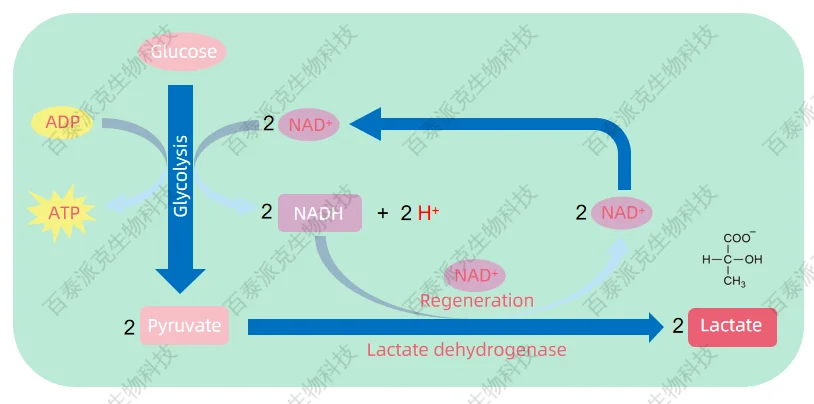
圖1. 有氧糖酵解
然而,近年來的研究表明,乳酸并非“無用之物”,而是具備多種調控功能的活性代謝分子。它不僅能作為代謝燃料在不同細胞之間“轉運利用”,還可通過特定的乳酸受體(如GPR81)參與細胞信號轉導,調節免疫、神經與內分泌活動。更重要的是,乳酸作為代謝中間物,能夠通過酰基化修飾賴氨酸殘基,形成一種新型的蛋白翻譯后修飾——乳酸化(lactylation),揭示了代謝狀態與基因表達之間直接耦聯的新機制。

Chen, J. et al. Signal Transduct Target Ther. 2025.
圖2. 乳酸是細胞內和細胞外重要的信號轉導子
在高代謝活動的細胞或組織中,如腫瘤細胞、活化的免疫細胞(如巨噬細胞)和缺血區域的組織細胞,乳酸常常呈現高濃度積累狀態。這些環境下產生的乳酸不再只是能量代謝的副產品,而是作為結構碳源參與調控基因表達。蛋白質乳酸化的發現為人們理解“代謝-表觀遺傳-功能”之間的轉化關系提供了新的視角,也為相關疾病的機制研究與干預策略開發打開了全新思路。

Hu Y, et al. Clin Epigenetics. 2024.
圖3. 蛋白質乳酸化調控基因表達和蛋白質功能
乳酸化機制
蛋白質乳酸化(lactylation)是一種新型賴氨酸翻譯后修飾,化學上表現為乳酸基團(–CO–CH?OH)通過酰胺鍵共價修飾蛋白質上的賴氨酸殘基。這一過程被認為主要依賴于代謝中間體——乳酰輔酶A(lactoyl-CoA)作為酰基供體,在一定酶促或非酶促條件下完成共價結合。lactoyl-CoA 的生成可能來源于糖酵解增強、乳酸積累或輔酶A參與下的代謝旁路活躍狀態。

Liu J, et al. Biomolecules. 2024.
圖4. 乳酸化的機制和調控
盡管乳酸化相關的“writer”酶(即介導乳酸化修飾的催化酶)尚未被系統確證,但已有研究提出p300/CBP等組蛋白乙酰轉移酶(HATs)可能具有雙功能,能在特定代謝背景下將乳酸基團轉移到組蛋白和非組蛋白賴氨酸上。有研究表明,p300在高乳酸條件下與乳酰輔酶A存在直接結合能力,可調節特定位點的乳酸化水平。此外,近期也有研究嘗試通過高通量篩選方式識別潛在的乳酸化轉移酶,但目前尚無特異性強、功能明晰的“writer”得到gōng rèn。
相較于writer系統,乳酸化的“eraser”酶(去乳酸化酶)研究則更加初步。某些去乙酰化酶家族成員,如HDACs或Sirtuins(特別是SIRT2、SIRT3),在體外實驗中被觀察到具有一定的去乳酸化活性,但其底物特異性、細胞內靶標及調控條件仍需進一步驗證。由于乳酸化與乙酰化在質量數與結構上接近,傳統酶篩選方法對兩者的識別區分存在技術挑戰,制約了eraser研究的深入。
此外,對于乳酸化是否存在“reader”蛋白——即識別乳酸化修飾并介導下游功能效應的結構域,目前尚無明確定義的乳酸化識別結構域(如乙酰化的bromodomain或甲基化的chromodomain)。然而,有研究推測某些轉錄因子或染色質重塑復合物可能通過感應乳酸化位點變化參與染色質狀態調控,這一方向仍處于早期探索階段。
值得注意的是,乳酸化與其他賴氨酸修飾(如乙酰化、甲基化、泛素化等)在同一位點可能存在競爭性關系,也可能形成串擾網絡。在應激、缺氧、炎癥等微環境下,這些修飾動態變化共同塑造蛋白質功能狀態和基因表達圖譜。因此,乳酸化不僅是一個獨立修飾事件,更嵌套在更復雜的“多修飾交互調控網絡”中,其調控模式具有顯著的條件依賴性和細胞特異性。

Song, H. et al. Genes Dis. 2022.
圖5. DNA損傷反應中乳酸化相互作用示意圖
組蛋白乳酸化與非組蛋白乳酸化
乳酸化最初是在組蛋白上被發現的,尤其是在組蛋白H3的賴氨酸殘基(如H3K18、H3K9)上。組蛋白乳酸化會改變染色質的結構狀態,從而調節基因轉錄活性。實驗表明,在缺氧或炎癥刺激下,組蛋白乳酸化水平升高,參與調節促炎因子、修復相關基因等的表達。隨著檢測技術的進步,越來越多的非組蛋白蛋白質也被發現可發生乳酸化修飾。這些蛋白包括轉錄因子、代謝酶、信號通路蛋白等,提示乳酸化不僅僅限于染色質調控,還可能直接影響細胞代謝、免疫識別、細胞遷移等多種生物過程,其功能范圍遠比最初設想的更加廣泛。
非組蛋白乳酸化修飾過程涉及一系列精細的酶促反應,首先是由乳酸化酶(如賴氨酸乳酸化轉移酶)將乳酸基團添加到目標蛋白質的賴氨酸殘基上。這一過程通常在細胞內的能量代謝壓力下發生,特別是在缺氧、炎癥反應或代謝應激條件下,乳酸濃度上升,激活乳酸化轉移酶。在乳酸化過程中,乳酸基團通過酰胺鍵與賴氨酸的氨基結合,形成可逆的乳酸化修飾。此修飾不僅改變蛋白質的構象和穩定性,還通過影響蛋白-蛋白相互作用、亞細胞定位及其催化活性,調控多種細胞過程,如基因轉錄、細胞周期、免疫反應和細胞遷移等,成為重要的生物學調控機制。

Yu, H. et al. Heliyon. 2024.
圖6. 非組蛋白乳酸化的產生
乳酸化與疾病:從機制到病理相關性
乳酸化正被逐步證實在多種重大疾病中發揮重要調控作用。其核心機制在于:乳酸積累通過修飾蛋白質賴氨酸殘基,改變基因表達和細胞功能,進而介入炎癥、免疫、代謝及神經系統等多層面調控。

Ren, H. et al. Nat Metab. 2025.
圖7. 腫瘤中的蛋白質乳酸化
乳酸化通過代謝感應與表觀調控的耦聯,在多類疾病中呈現出重要的調節作用,未來有望成為疾病干預的新靶點。
乳酸化相關的治療靶點與干預策略
由于乳酸化在疾病中的重要作用,越來越多研究開始探索其作為治療靶點的可行性。一個重要思路是通過調節細胞內的乳酸濃度來間接影響乳酸化水平。例如,抑制乳酸生成的乳酸脫氫酶(LDH)抑制劑或阻斷乳酸外排的單羧酸轉運蛋白(MCT)抑制劑已被用于實驗性治療中。

Benjamin, D. et al. Cell Rep. 2018.
圖8. MCT抑制劑昔洛舍平抑制乳酸生成的機制
同時,研究人員也在嘗試尋找乳酸化的“writer”、“eraser”和“reader”蛋白質,以開發靶向酶調控的干預策略。盡管目前尚無乳酸化特異性的小分子藥物進入臨床,但它已成為表觀調控與代謝干預結合的新興領域,未來具有巨大的轉化潛力。

Hu, XT. et al. J Adv Res. 2024.
圖9. 靶向乳酸化調控策略
乳酸化分析方法
乳酸化的發現離不開先進的質譜技術,目前主流的分析流程包括:蛋白質酶解后富集乳酸化肽段,采用高分辨率LC-MS/MS進行檢測,并通過數據庫比對與人工校正實現乳酸化位點的鑒定與定量。常用的數據庫搜索引擎如pFind、Byonic等,已支持乳酸化修飾的識別。

Liu, J. et al. Biomolecules. 2024.
圖10. 乳酸化分析流程
此外,為提升檢測靈敏度和特異性,研究者還在開發乳酸化特異性抗體,用于Western blot或免疫富集。未來,隨著抗體質量提升和多重串擾識別算法的發展,乳酸化組學將從“發現階段”邁入“功能解析與系統建模”階段,推動該領域的進一步成熟。
結語
乳酸化作為一種代謝驅動型的蛋白質修飾方式,正逐步改變人們對“乳酸只是廢物”的舊有認知。它在連接代謝狀態、染色質狀態與細胞功能方面發揮著橋梁作用,為我們理解疾病機制、發現治療靶點、構建調控網絡提供了新的視角。
雖然目前關于乳酸化的研究仍處于起步階段,存在機制不清、技術受限等問題,但其科學意義和應用潛力無可忽視。百泰派克將持續關注并推進乳酸化相關的蛋白質組學技術開發,為基礎研究與生物醫藥轉化提供有力支持。
如需了解百泰派克在乳酸化修飾研究方面的分析服務,歡迎聯系我們的技術團隊獲取詳細信息與個性化方案建議。
關于我們
北京百泰派克生物科技有限公司致力于為生物/制藥和醫療器械行業提供質量控制檢測和項目驗證等專業服務。公司實驗室遵循NMPA、ICH、FDA和EMA等的法規和指導原則,通過CNAS/ISO9001雙重質量體系認證,建立了完備的質量體系,數據冷熱/異地備份,設備定期計量/期間核查,軟件審計追蹤,為客戶提供一體化解決方案和技術服務,支持新藥研發、藥物申報注冊和生產放行。
1.公司采用ISO9001質量控制體系,專業提供以質譜為基礎的CRO檢測分析服務;
2.獲國家CNAS實驗室認可,為客戶提供符合全球藥政法規的藥物質量研究服務;
3.業務范圍覆蓋蛋白質組學、多肽組學、代謝組學、生物藥物表征、單細胞分析、單細胞質譜流式、生信云分析以及多組學生物質譜整合分析等;
4.七大質量控制檢測平臺,滿足您一站式服務需求;
5.服務3000+企業,10000+客戶的選擇;
6.致力于為您提供優質的生物質譜分析服務!
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號



















 采購中心
采購中心