
研究背景:
結直腸癌是全球五大致命癌癥之一,在中國是第二大常見惡性腫瘤。肝轉移是患者預后不良的主要原因,25%的患者初診時已有肝轉移,
術后15%-25%因肝轉移復發,90%的肝轉移患者無法獲得有效治療,IV期患者5年生存率僅24%。N-糖基化修飾在蛋白質的多種功能中起關鍵作用,
且與惡性腫瘤轉移相關,但目前關于結直腸癌肝轉移相關的N-糖基化蛋白質組學研究較少。
研究方法:
收集14例結直腸癌肝轉移患者的原發性病灶和配對肝轉移病灶樣本,經處理后進行液相色譜-質譜(LC-MS)分析。對多種細胞系進行培養,
構建CTSD突變體,通過轉染、感染等操作,進行細胞增殖、遷移、侵襲、凋亡等實驗。構建裸鼠皮下腫瘤和肝轉移模型,觀察腫瘤生長和
轉移情況。
主要研究結果:
1. CRC患者肝轉移性病變表現出比原發性病變更高的CTSD N-糖基化水平
通過質譜技術,研究人員對比了14例原發性病灶和14例配對肝轉移病灶的N-糖基化修飾差異,共檢測到139種N-糖基化蛋白、185個N -糖基化
修飾位點、490個完整結構的N-糖肽以及71種糖基。其中46個N-糖基化修飾位點此前未被Uniprot平臺報道。在肝轉移病灶中,有13個位點的
N-糖基化修飾水平變化超過1.5倍。N-糖基化位點周圍的氨基酸序列具有一定保守性。44.94%的N-糖基化位點被單一、固定的糖基修飾,
20.86%的N-糖蛋白含有多個N-糖基化修飾位點。借助GO和KEGG分析發現,這些N-糖基化蛋白可能屬于分泌蛋白和膜蛋白。在生物學過程方面,
主要參與細胞間粘附、蛋白水解和免疫反應等;分子功能則主要與結合活性相關。KEGG通路富集分析表明,它們可能涉及溶酶體、
細胞外基質-受體相互作用以及藥物-受體等相關途徑。此外,在 Cathepsin D(CTSD)的第263位殘基處,發現 2488.06545(PrecursorMH)
作為H (6) N (2) 糖基的結構修飾,在肝轉移病灶相對于原發性病灶的修飾變化倍數絕對值最高。同時,H (5) N (2)和H (7) N (2)的
N-糖基化修飾水平在肝轉移病灶中也顯著增加,這表明肝轉移病灶中CTSD第263位殘基的N-糖基化修飾水平整體高于原發性病灶。

圖1結直腸癌原發性病灶和配對肝轉移病灶中N - 糖基化蛋白的相關分析
2. CTSD糖基化修飾特征及相關位點突變對蛋白的影響
對5例CRC患者的原發性病灶和配對肝轉移病灶進行檢測,發現肝轉移病灶中CTSD的N -糖基化水平高于原發性病灶。同時,
在多種CRC細胞系中評估CTSD的糖基化水平,CTSD在不同CRC細胞系中的糖基化水平存在差異。使用PNGase F和衣霉素處理細胞系后,
CTSD 的分子量下降,表明CTSD存在N-糖基化修飾,且經處理后從糖基化形式轉變為非糖基化形式。分析發現CTSD在
天冬酰胺殘基 263(N263)處具有進化保守性。UniProt 蛋白數據庫預測CTSD有2個潛在N-糖基化位點(天冬氨酸殘基134和263)。
隨后在SW480和 SW620 細胞系中沉默內源性CTSD 表達,再分別轉導編碼野生型 CTSD(CTSD WT)或突變型CTSD
(CTSD N263Q、CTSD N134Q/N263Q)的外源質粒,成功構建穩定表達細胞模型。通過對比突變前后及經 PNGase F 處理后的CTSD
分子量變化,確定CTSD僅在殘基 134和263處存在N-糖基化修飾位點。

圖2 CTSD N-糖基化修飾位點驗證
3. CTSD N263位點糖基化修飾促進CRC生長和轉移
將CTSD野生型(WT)和N263Q突變型(非糖基化)的SW480細胞分別皮下注射至裸鼠,成瘤實驗的結果表明CTSD WT組腫瘤體積顯著
大于N263Q組,且腫瘤外觀更明顯、重量更重。在肝轉移裸鼠模型中,WT組裸鼠肝臟表面可見明顯轉移結節,而N263Q組肝臟無肉眼可
見轉移灶;HE染色顯示WT組肝臟存在典型轉移灶,N263Q組肝臟組織正常,無轉移跡象,表明CTSD在N263位點的N -糖基化修飾是其
促進CRC生長和肝轉移的關鍵因素,缺失該修飾(N263Q突變)會導致腫瘤增殖能力下降、皮下腫瘤生長速度顯著減慢、轉移潛能喪失。

圖3 CTSD N263位點糖基化修飾位點驗證對CRC生長和轉移的影響
4. CTSD N-糖基化修飾對其細胞定位、穩定性及功能活性的影響
GeneCards顯示CTSD主要分布于細胞外基質、溶酶體和內體。免疫熒光實驗發現野生型(WT)CTSD與溶酶體標記物LAMP1、早期
內體標記物EEA1、晚期內體標記物Rab7共定位,表明其正常運輸至溶酶體和內體;而突變體(N263Q、N134Q/N263Q)CTSD全喪失與
上述標記物的共定位能力,滯留于細胞質或錯誤定位。單突變體(N263Q)CTSD分泌量顯著低于WT細胞,提示N263糖基化缺失抑制其分泌;
而雙突變體(N134Q/N263Q)CTSD 分泌量反而高于WT細胞,表明雙位點糖基化缺失可能解除某種分泌抑制機制。環己酰亞胺(CHX)
追蹤顯示WT CTSD在處理5小時后仍保持較高水平,半衰期較長,N263Q 突變體CTSD在處理3小時后顯著降解,半衰期縮短。使用CTSD
特異性底物(GKPILFFRLK (Dnp)-D-R-NH2)和熒光法檢測發現,WT CTSD的酶活性顯著高于N263Q和N134Q/N263Q 突變體,雙突變體
酶活性低,單突變體次之,表明糖基化位點數量與酶活性呈正相關。這表明N263糖基化是CTSD進入溶酶體/內體的必要條件,確保其在
酸性環境中發揮功能,糖基化抑制蛋白降解,延長CTSD的半衰期,并直接影響CTSD的催化效率,促進其蛋白酶功能。此外,N263位點在
定位和穩定性調控中起主導作用,而N134可能通過協同作用影響分泌和酶活。

圖4 CTSD第134和263位的N-糖基化調節其折疊位置、穩定性和功能活性
5. CTSD N-糖基化修飾的調控機制研究
隨后探究了 CTSD的N-糖基化修飾的調控機制,重點鑒定了參與其糖基化的轉移酶復合體及關鍵亞基。利用FLAG標簽富集CTSD
野生型(WT)和N263Q突變體的互作蛋白,通過質譜分析差異結合蛋白,發現CTSD WT特異性結合235種蛋白,N263Q結合191種蛋白,
其中45種蛋白僅與WT互作,其中DDOST是唯的N -糖基轉移酶。N -糖基化起始于內質網中的寡糖轉移酶(OST)復合體,分為OST-A
(催化亞基 STT3A)和OST-B(催化亞基STT3B),非催化亞基如DDOST可穩定復合體與底物的結合。隨后,通過CPTAC數據庫
分析發現,STT3A、STT3B和DDOST在結腸癌組織中均顯著高表達,提示其與CRC進展相關。在SW480 細胞中敲除STT3B或DDOST后,
CTSD分子量顯著降低,表明N- 糖基化修飾缺失;而敲除STT3A無明顯變化。免疫共沉淀驗證發現,CTSD WT與STT3B、DDOST
顯著互作,而N263Q突變體與兩者的結合能力明顯減弱,CTSD與STT3A無明顯結合,表明STT3B是主要催化亞基。此外,免疫熒光共
定位的結果表明CTSD與STT3B、DDOST在細胞質和內質網區域顯著共定位,而與STT3A無共定位。

圖5 CTSD N-糖基轉移酶鑒定
6. CTSD的N-糖基化修飾通過降解ACADM、調控鐵死亡促進CRC肝轉移的分子機制
通過比較CTSD野生型(WT)和N263Q突變型SW480 細胞的蛋白質組,篩選鑒定出391個差異表達蛋白(DEPs),其中WT中高表達的蛋白
主要富集于蛋白酶活性、細胞遷移等通路,N263Q中高表達的蛋白涉及脂肪酸代謝、抗氧化反應等,通過CTSD WT特異性互作蛋白與
DEPs的交集分析,初步篩選出8個候選分子:ACADM、PRDX3、ALDH2、EHHADH、DHCR7、TGFB1I1、IDH2、ALDH1A1。臨床
相關性分析顯示,ACADM和PRDX3高表達患者的預后顯著優于低表達者,提示兩者可能為抑癌因子;TNM 分期分析發現ACADM表達隨
CRC惡性程度(TNM分期)進展而降低,在肝轉移(IV 期)患者中表達低,表明 ACADM與轉移負相關,因此選為后續研究靶點。
在CTSD WT和N263Q細胞中,CTSD表達水平相當,但N263Q細胞的ACADM蛋白水平顯著升高,提示CTSD糖基化促進 ACADM 降解。
此外,Co-IP的結果表明CTSD WT與ACADM顯著結合,而N263Q突變體無法與 ACADM互作,表明CTSD的N263糖基化是其結合并降解
ACADM的前提。最后,在90 例CRC組織中,CTSD 表達與ACADM 呈顯著負相關,且兩者在細胞質中共定位,進一步驗證 CTSD 對
ACADM 的降解作用在臨床樣本中普遍存在。
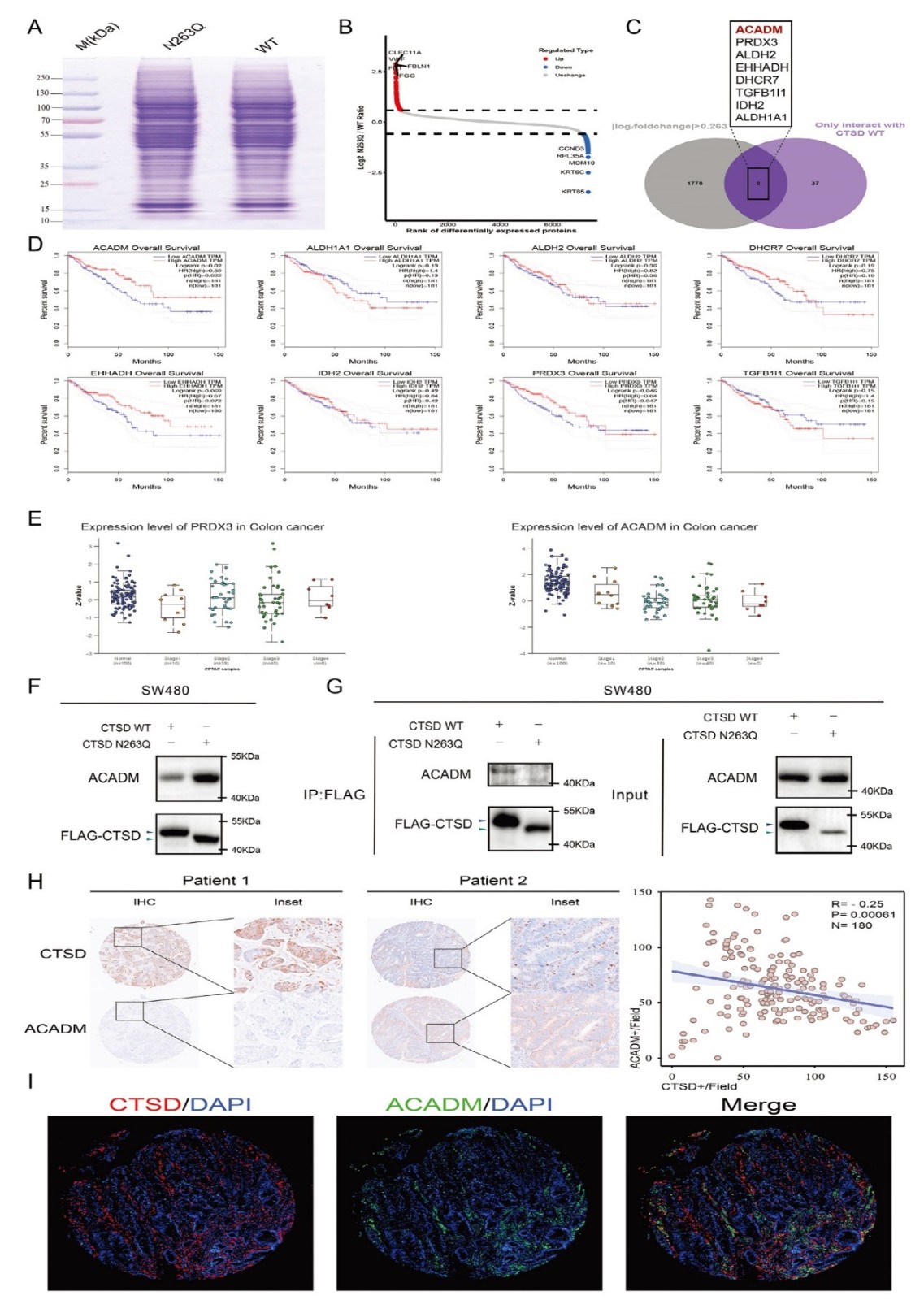
圖6 CTSD N263-糖基化修飾影響CTSD蛋白酶對ACADM的蛋白水解作用
研究結論:
本研究聚焦結直腸癌肝轉移中N-糖基化修飾機制,CTSD的N263位點糖基化在肝轉移灶中顯著上調,該修飾由STT3B和DDOST糖基轉移酶
復合體調控。CTSD糖基化通過維持其溶酶體定位、穩定性及蛋白酶活性,促進降解ACADM蛋白,進而調控鐵死亡相關蛋白(ACSL4、
SLC7A11、GPX4),增強CRC細胞侵襲轉移能力。體內實驗顯示,敲除N263 糖基化可抑制裸鼠腫瘤生長及肝轉移。該研究揭示CTSD-N263
糖基化通過“STT3B/DDOST-ACADM-鐵死亡軸" 驅動轉移,為CRC治療提供了新靶點與理論依據。
研究思維導圖:

參考文獻:
Xiong N, Du Y, Huang C, Yan Q, Zhao L, Yang C, Sun Q, Gao Z, Wang C, Zhan J, Zhang H, Wang S, Ye Y, Li Y, Shen Z. N-glycosylation Modification of CTSD Affects Liver Metastases in Colorectal Cancer. Adv Sci (Weinh). 2025 Feb;12(7): e2411740. doi: 10.1002/advs.202411740. Epub 2024 Dec 24. PMID: 39716927; PMCID: PMC11831497.