重磅!2021年中國(guó)大輸液行業(yè)相關(guān)政策匯總及解讀(全) 全面實(shí)行MAH制度
注射給藥途徑雖然有吸收快、藥量準(zhǔn)確可控的優(yōu)點(diǎn),但可引起組織損傷、疼痛、感染,甚至引發(fā)嚴(yán)重不良反應(yīng)的缺點(diǎn)也十分明顯。在經(jīng)歷了三十多年的爆發(fā)式發(fā)展之后,我國(guó)大輸液安全事故的頻發(fā)逐漸引起監(jiān)管部門的關(guān)注,相關(guān)行業(yè)政策也逐漸趨嚴(yán)。
2019年,國(guó)家藥監(jiān)局發(fā)布關(guān)于貫徹實(shí)施《中華人民共和國(guó)藥品管理法》有關(guān)事項(xiàng)的公告,自2019年12月1日起,取消藥品GMP、GSP認(rèn)證,不再受理GMP、GSP認(rèn)證申請(qǐng),不再發(fā)放藥品GMP、GSP證書。
行業(yè)相關(guān)標(biāo)準(zhǔn)
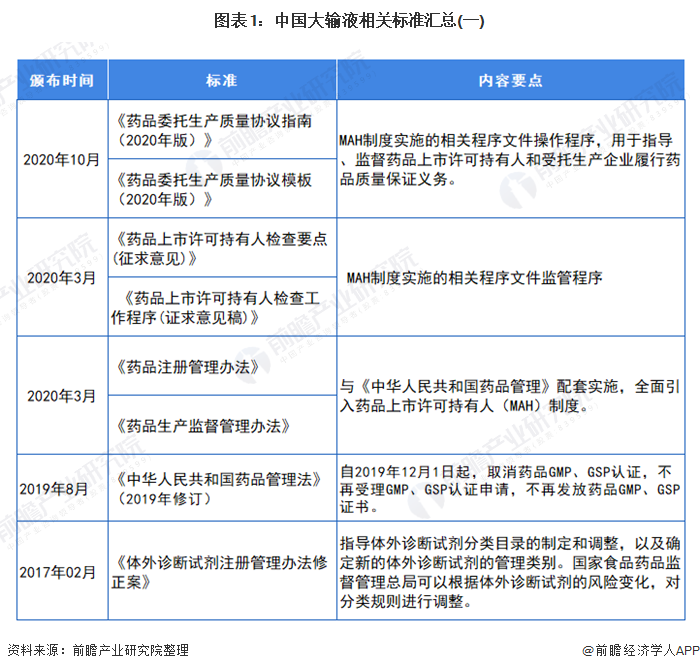
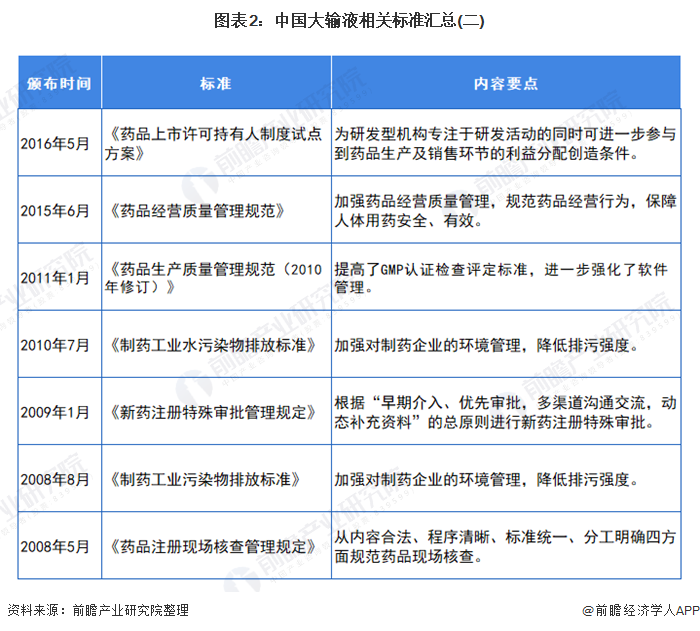
我國(guó)制定了嚴(yán)格的行業(yè)標(biāo)準(zhǔn)來(lái)規(guī)范醫(yī)藥行業(yè),其中主要有:《藥品管理法》(中華人民共和國(guó)主席令第45號(hào))、《藥品管理法實(shí)施條例》(國(guó)務(wù)院令第360號(hào))、《藥品注冊(cè)管理辦法》(國(guó)家藥監(jiān)局令第28號(hào))、《藥品經(jīng)營(yíng)許可證管理辦法》(國(guó)家藥監(jiān)局令第6號(hào))、《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(國(guó)家藥監(jiān)局令第3號(hào))、《藥品進(jìn)口管理辦法》(國(guó)家藥監(jiān)局令第4號(hào))、《藥物非臨床研究質(zhì)量管理規(guī)范》(國(guó)家藥監(jiān)局令第2號(hào))、《藥品經(jīng)營(yíng)質(zhì)量管理規(guī)范》(國(guó)家藥品監(jiān)督管理局令第20號(hào))、《藥品生產(chǎn)質(zhì)量管理規(guī)范》(國(guó)家藥品監(jiān)督管理局令第9號(hào))等。與化學(xué)藥品制劑行業(yè)發(fā)展相關(guān)的法律法規(guī)主要如下表所示:
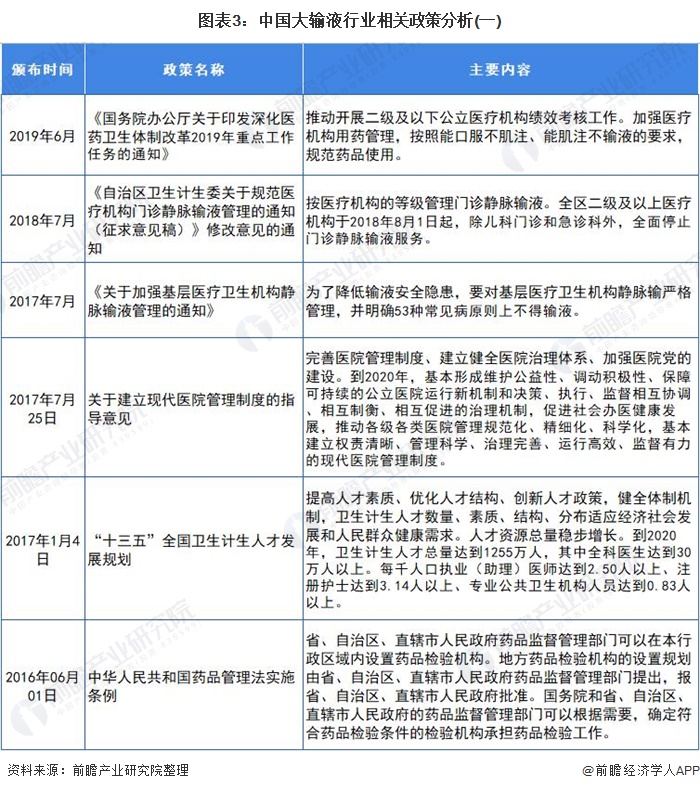
行業(yè)相關(guān)政策
注射給藥途徑雖然有吸收快、藥量準(zhǔn)確可控的優(yōu)點(diǎn),但可引起組織損傷、疼痛、感染,甚至引發(fā)嚴(yán)重不良反應(yīng)的缺點(diǎn)也十分明顯。在經(jīng)歷了三十多年的爆發(fā)式發(fā)展之后,我國(guó)大輸液安全事故的頻發(fā)逐漸引起監(jiān)管部門的關(guān)注,相關(guān)行業(yè)政策也逐漸趨嚴(yán)。
2012年8月,有“史上最嚴(yán)限抗令”之稱的《抗菌藥物臨床應(yīng)用管理辦法》正式實(shí)施。根據(jù)《辦法》,抗菌藥物將依據(jù)安全性、療效、細(xì)菌耐藥性、價(jià)格等因素,被分為非限制使用級(jí)、限制使用級(jí)和特殊使用級(jí)三個(gè)級(jí)別。醫(yī)療機(jī)構(gòu)和醫(yī)療人員應(yīng)嚴(yán)格掌握使用抗菌藥物預(yù)防感染的指征。違規(guī)使用抗菌藥物的醫(yī)師,將被警告、限制處方權(quán)、吊銷執(zhí)業(yè)證書,甚至追究刑事責(zé)任。
據(jù)國(guó)家藥品不良反應(yīng)監(jiān)測(cè)中心發(fā)布的2019年藥品不良反應(yīng)/事件報(bào)告數(shù)據(jù)顯示,注射給藥占62.8%,遠(yuǎn)超占比32.5%的口服給藥,在注射給藥中,靜脈注射給藥又占到了92.5%。報(bào)告再次強(qiáng)調(diào):能口服給藥的,不選用注射給藥;能肌肉注射給藥的,不選用靜脈注射或滴注給藥。預(yù)計(jì)近幾年,我國(guó)大輸液行業(yè)政策仍將保持高壓狀態(tài)。

行業(yè)最新動(dòng)態(tài)解讀
1、取消GMP、GSP認(rèn)證
2012年,我國(guó)擁有300多家大輸液企業(yè),在“限抗令”的推動(dòng)下,實(shí)力較弱的小型企業(yè)退出市場(chǎng)速度加快。到2013年底,有110余家大輸液企業(yè)由于未能通過(guò)GMP認(rèn)證停產(chǎn),行業(yè)企業(yè)數(shù)量迅速減少了三分之一左右。截止2021年4月,在企查查輸入“大輸液”關(guān)鍵字,選出經(jīng)營(yíng)范圍為大輸液的、存續(xù)/在業(yè)的制造業(yè)企業(yè)數(shù)量不足100家。我國(guó)大輸液行業(yè)經(jīng)過(guò)不斷的優(yōu)勝劣汰,許多企業(yè)被淘汰,行業(yè)集中度大幅提升。
2019年,國(guó)家藥監(jiān)局發(fā)布關(guān)于貫徹實(shí)施《中華人民共和國(guó)藥品管理法》有關(guān)事項(xiàng)的公告,自2019年12月1日起,取消藥品GMP、GSP認(rèn)證,不再受理GMP、GSP認(rèn)證申請(qǐng),不再發(fā)放藥品GMP、GSP證書。2019年12月1日以前受理的認(rèn)證申請(qǐng),按照原藥品GMP、GSP認(rèn)證有關(guān)規(guī)定辦理。
取消藥品GMP、GSP認(rèn)證,有著如下意義:
1、取消GMP認(rèn)證并不會(huì)降低藥品質(zhì)量標(biāo)準(zhǔn),也不意味著藥企生產(chǎn)門檻的降低,相反,藥企將面臨更加常態(tài)化和嚴(yán)苛的檢查。以往藥品GMP認(rèn)證相當(dāng)于頒給企業(yè)一個(gè)五年有效的合格證,即使企業(yè)不按照規(guī)范生產(chǎn),也往往因有政府認(rèn)證的資質(zhì)而規(guī)避自身責(zé)任。未來(lái)取消以事前認(rèn)證形式監(jiān)管之后,藥企將面臨更加嚴(yán)格的各類檢查,特別是事先不告知的飛行檢查。
2、隨著產(chǎn)業(yè)管理水平、質(zhì)量意識(shí)的提高,簡(jiǎn)化行政審批,進(jìn)行簡(jiǎn)政放權(quán),將極大地降低了企業(yè)運(yùn)營(yíng)成本,有效激發(fā)醫(yī)藥產(chǎn)業(yè)活力,利于藥品安全與行業(yè)創(chuàng)新。
3、取消GMP、GSP認(rèn)證和落實(shí)藥品上市許可持有人(MAH)制度之間是相互促進(jìn)的。藥品上市許可人制度是指將上市許可與生產(chǎn)許可分離的管理模式。這種機(jī)制下,上市許可和生產(chǎn)許可相互獨(dú)立,上市許可持有人可以將產(chǎn)品委托給不同的生產(chǎn)商生產(chǎn),藥品的安全性、有效性和質(zhì)量可控性均由上市許可人對(duì)公眾負(fù)責(zé)。M
AH制度是國(guó)際較為通行的藥品上市、審批制度,是一項(xiàng)與世界接軌的制度,具有一定的制度優(yōu)勢(shì),可在一定程度上緩解目前“捆綁”管理模式下出現(xiàn)的問(wèn)題,從源頭上抑制制藥企業(yè)的低水平重復(fù)建設(shè),提高新藥研發(fā)的積極性,促進(jìn)委托生產(chǎn)的繁榮,從而推進(jìn)我國(guó)醫(yī)藥產(chǎn)業(yè)的快速發(fā)展。
也就是說(shuō),以往藥品在申報(bào)前就和GMP認(rèn)證的藥廠綁定了,認(rèn)證的取消使藥企可先申報(bào)新藥后,再委托任何一個(gè)符合條件的藥廠去加工生產(chǎn),這對(duì)于鼓勵(lì)藥品的研發(fā)生產(chǎn)具有促進(jìn)意義。
4、從行政審批制度改革的深入程度來(lái)看,一整套鼓勵(lì)藥品研發(fā)、創(chuàng)新的配套制度正在逐漸完善。
2、全面實(shí)行MAH制度
2020年3月,為進(jìn)一步規(guī)范持有人檢查工作,國(guó)家藥監(jiān)局組織起草了《藥品上市許可持有人檢查工作程序(征求意見(jiàn)稿)》《藥品上市許可持有人檢查要點(diǎn)(征求意見(jiàn)稿)》。文件指出,持有人檢查包括現(xiàn)場(chǎng)檢查和書面檢查兩種形式,現(xiàn)場(chǎng)檢查指藥品監(jiān)督管理部門委派檢查組至持有人研制、生產(chǎn)、經(jīng)營(yíng)相關(guān)活動(dòng)現(xiàn)場(chǎng)進(jìn)行核查的檢查方式;書面檢查指藥品監(jiān)督管理部門要求持有人遞交檢查材料,并對(duì)其遞交材料進(jìn)行核查的檢查方式。
同樣是2020年3月,國(guó)家市場(chǎng)監(jiān)督管理總局公布《藥品注冊(cè)管理辦法》和新修訂的《藥品生產(chǎn)監(jiān)督管理辦法》,兩部規(guī)章將于2020年7月1日起正式施行,與《中華人民共和國(guó)藥品管理》配套實(shí)施。規(guī)章中提到,全面落實(shí)藥品上市許可持有人制度。
明確申請(qǐng)人為能夠承擔(dān)相應(yīng)責(zé)任的企業(yè)或者藥品研制機(jī)構(gòu)等,要求建立藥品質(zhì)量保證體系,對(duì)藥品的全生命周期進(jìn)行管理,開(kāi)展上市后研究,承擔(dān)上市藥品的安全有效和質(zhì)量責(zé)任。
《藥品注冊(cè)管理辦法》和《藥品生產(chǎn)監(jiān)督管理辦法》是藥品監(jiān)管領(lǐng)域的兩項(xiàng)核心配套規(guī)章,分別是我國(guó)藥品研發(fā)和注冊(cè)管理和上市藥品生產(chǎn)管理的重要操作性規(guī)章,也是繼《疫苗管理法》于2019年6月出臺(tái)、《藥品管理法》于2019年8月完成重大修訂后,藥品監(jiān)管領(lǐng)域后續(xù)出臺(tái)的兩個(gè)重量級(jí)部門規(guī)章,這兩個(gè)規(guī)章將分別替代目前施行的2007年《藥品注冊(cè)管理辦法》和2004年《藥品生產(chǎn)監(jiān)督管理辦法》。
新《藥品管理法》的最大變化也是最大亮點(diǎn)就是藥品上市許可持有人(MAH)制度的全面引入(實(shí)際上早于新《藥品管理法》問(wèn)世的《疫苗管理法》已正式使用了這一試點(diǎn)多年的創(chuàng)新制度),藥品上市許可持有人作為藥品行業(yè)監(jiān)管的核心對(duì)象和主要責(zé)任載體貫穿了整部新法,藥品上市許可持有人也將是“藥品注冊(cè)證書”中須載明的一項(xiàng)關(guān)鍵信息。
新法要求持有人應(yīng)具備質(zhì)量管理能力、風(fēng)險(xiǎn)防控能力和責(zé)任賠償能力,對(duì)藥品的非臨床研究、臨床試驗(yàn)、生產(chǎn)、經(jīng)營(yíng)、上市后研究、不良反應(yīng)監(jiān)測(cè)及報(bào)告與處理等承擔(dān)責(zé)任,依法對(duì)藥品研制、生產(chǎn)、經(jīng)營(yíng)、使用全過(guò)程中藥品的安全性、有效性和質(zhì)量可控性負(fù)責(zé)。
2020年10月,為貫徹《藥品管理法》有關(guān)規(guī)定,進(jìn)一步加強(qiáng)藥品生產(chǎn)監(jiān)督管理,國(guó)家藥監(jiān)局組織制定了《藥品委托生產(chǎn)質(zhì)量協(xié)議指南(2020年版)》和《藥品委托生產(chǎn)質(zhì)量協(xié)議模板(2020年版)》,用于指導(dǎo)、監(jiān)督藥品上市許可持有人和受托生產(chǎn)企業(yè)履行藥品質(zhì)量保證義務(wù),自發(fā)布之日起施行。
由此可見(jiàn),自2019年取消藥品GMP、GSP認(rèn)證后,國(guó)家進(jìn)一步出臺(tái)了一系列的規(guī)章制度,促進(jìn)MAH制度的全面實(shí)施。
3、GMP證書尚在有效期范圍內(nèi)的部分大輸液企業(yè)
自2019年,國(guó)家藥監(jiān)局取消藥品GMP、GSP認(rèn)證后,國(guó)家不再受理GMP、GSP認(rèn)證申請(qǐng),不再發(fā)放藥品GMP、GSP證書。因此,持有GMP認(rèn)證的大輸液企業(yè)越來(lái)越少。截止2021年4月,前瞻統(tǒng)計(jì)的GMP證書尚在有效期范圍內(nèi)的部分企業(yè)和證書如下:

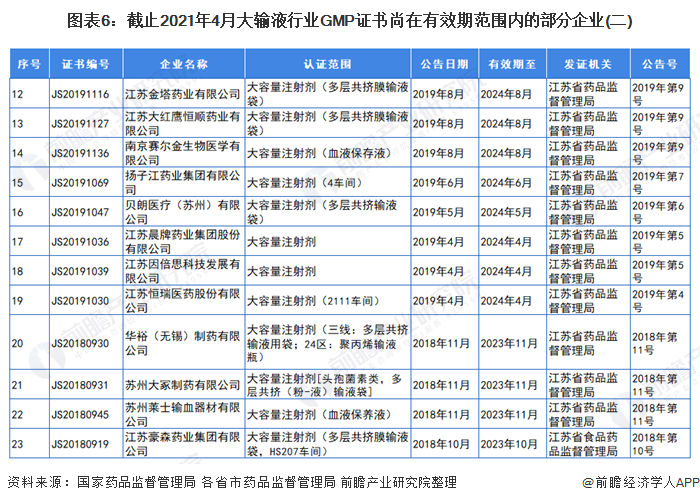
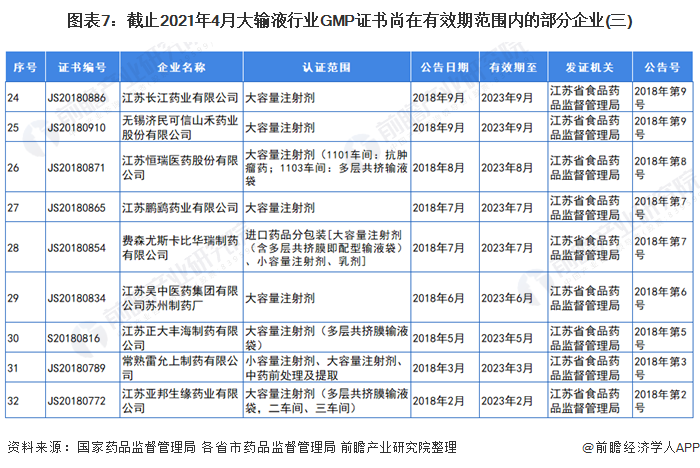
注:證書編號(hào)CN開(kāi)頭的為國(guó)家藥品監(jiān)督管理局頒發(fā)的證書,有效期范圍內(nèi)的企業(yè)已全部展示。其他證書編號(hào)開(kāi)頭的為各省市藥品監(jiān)督管理局頒發(fā)的證書,以北京市和江蘇省為例。
更多行業(yè)資料敬請(qǐng)關(guān)注前瞻產(chǎn)業(yè)研究院發(fā)布的《中國(guó)大輸液行業(yè)發(fā)展前景預(yù)測(cè)與投資戰(zhàn)略規(guī)劃分析報(bào)告》,同時(shí)前瞻產(chǎn)業(yè)研究院提供產(chǎn)業(yè)大數(shù)據(jù)、產(chǎn)業(yè)規(guī)劃、產(chǎn)業(yè)申報(bào)、產(chǎn)業(yè)園區(qū)規(guī)劃、產(chǎn)業(yè)招商引資、IPO募投可研等解決方案。
更多深度行業(yè)分析盡在【前瞻經(jīng)濟(jì)學(xué)人APP】,還可以與500+經(jīng)濟(jì)學(xué)家/資深行業(yè)研究員交流互動(dòng)。
前瞻產(chǎn)業(yè)研究院 - 深度報(bào)告 REPORTS
本報(bào)告第1章分析了中國(guó)大輸液行業(yè)的發(fā)展環(huán)境;第2章分析了美國(guó)、歐洲、日本以及中國(guó)大輸液行業(yè)的發(fā)展?fàn)顩r;第3章對(duì)大輸液行業(yè)的細(xì)分市場(chǎng)進(jìn)行了分析;第4章對(duì)中國(guó)大輸液行...
如在招股說(shuō)明書、公司年度報(bào)告中引用本篇文章數(shù)據(jù),請(qǐng)聯(lián)系前瞻產(chǎn)業(yè)研究院,聯(lián)系電話:400-068-7188。
品牌、內(nèi)容合作請(qǐng)點(diǎn)這里:尋求合作 ››

前瞻經(jīng)濟(jì)學(xué)人
專注于中國(guó)各行業(yè)市場(chǎng)分析、未來(lái)發(fā)展趨勢(shì)等。掃一掃立即關(guān)注。





























