維立志博,追“月亮”的人
作者|陳晨 來(lái)源|醫(yī)曜
“大多數(shù)人所成為的,并非是他們想成為的人,而是不得不成為的人。”這其實(shí)亦是中國(guó)創(chuàng)新藥產(chǎn)業(yè)的真實(shí)寫(xiě)照。
維立志博IPO時(shí)的火爆,讓很多投資者認(rèn)為這是一家創(chuàng)新藥領(lǐng)域的“超新星”。但實(shí)際上,維立志博早在2012年就已經(jīng)成立,算得上是與康方生物、信達(dá)生物、君實(shí)生物等站在同一起跑線的老牌創(chuàng)新藥企。往日對(duì)手早已成為中國(guó)創(chuàng)新藥中堅(jiān)力量之時(shí),維立志博才姍姍來(lái)遲登陸資本市場(chǎng)。并不是維立志博做得不夠好,而是它執(zhí)著堅(jiān)守自己信念中的“月亮”。
十多年前,PD-1靶點(diǎn)被認(rèn)為是兵家必爭(zhēng)之地,信達(dá)、君實(shí)等都果斷押注這個(gè)方向,并成了行業(yè)里的 “明星公司”。面對(duì)PD-1這個(gè)“六便士”,維立志博并沒(méi)有選擇妥協(xié),而是堅(jiān)持了自己心中的方向。維立志博創(chuàng)始人康小強(qiáng)曾提到,2014 年回國(guó)調(diào)研時(shí)發(fā)現(xiàn),已有二三十家企業(yè)扎堆 PD- 1,“市場(chǎng)不需要我們重復(fù)勞動(dòng)”。
因此,維立志博沒(méi)有去做PD-1,而是選擇去解決PD-1沒(méi)有解決的問(wèn)題。眾所周知,PD-1響應(yīng)率較低,有80%左右的患者對(duì)其沒(méi)有響應(yīng),這背后存在龐大的市場(chǎng)需求,但卻又是一條無(wú)人走過(guò)的荊棘之路。艱難前行十三載,維立志博依然顆粒無(wú)收,這無(wú)疑就是堅(jiān)守“月亮”的代價(jià)。
但維立志博是幸運(yùn)的,趕上了生物制藥的回暖。沖刺上市之際,資本市場(chǎng)相當(dāng)狂熱,3029倍認(rèn)購(gòu)倍數(shù)、3400 億港元凍結(jié)資金,創(chuàng)下近3年港股生物科技板塊 IPO 之最。資本市場(chǎng)用真金白銀投票,這是對(duì)維立志博“不跟風(fēng)”的最大褒獎(jiǎng)。
“不跟風(fēng)”的選擇,透露出維立志博心中的志向。可“月亮”是無(wú)法吃飽飯的,尤其是登陸資本市場(chǎng)后,更是需要直面市場(chǎng)“六便士”的考驗(yàn)。維立志博還會(huì)堅(jiān)定當(dāng)初的理想嗎?
一
“硬骨頭”難啃
PD-L1/4-1BB雙抗LBL-024,正是維立志博當(dāng)年堅(jiān)守的“月亮”。在PD-1單抗競(jìng)爭(zhēng)激烈的今天,PD-L1/4-1BB雙抗依然是一塊“難啃的硬骨頭”。
一直以來(lái),4-1BB靶點(diǎn)的研發(fā)并不順利,全球也尚無(wú)靶向4-1BB上市藥物。這一靶點(diǎn)最早于1989年由百時(shí)美施貴寶(BMS)發(fā)現(xiàn),近四十年的研發(fā)歷程中,因4-1BB的廣泛表達(dá),過(guò)度激活機(jī)體T細(xì)胞則會(huì)帶來(lái)潛在的肝毒性和全身免疫反應(yīng),眾多藥企折戟沉沙。而LBL-024作為全球首款進(jìn)入關(guān)鍵注冊(cè)臨床階段的4-1BB靶向藥物,正試圖打破這一僵局。
第一代4-1BB激動(dòng)劑是BMS開(kāi)發(fā)的Urelumab,但在臨床中因肝毒性造成兩名受試死亡,研發(fā)以失敗告終。后續(xù),輝瑞又開(kāi)發(fā)了第二代4-1BB激動(dòng)劑utomilumab,雖然控制住了嚴(yán)重的毒性,但無(wú)論單藥還是聯(lián)合利妥昔的療效都非常有限,也沒(méi)能逃脫失敗的命運(yùn)。
這樣的情況下,藥企紛紛將目光投向了4-1BB雙抗研發(fā),其中熱度最高就是PD-L1/4-1BB雙抗,其有望通過(guò)“踩剎車(chē)加油”的復(fù)合機(jī)制,提升腫瘤殺傷效果。但在這條路上不少藥企也失敗了。去年,由于安全性問(wèn)題施維雅終止了與合作伙伴研發(fā)PD-1/4-1BB。無(wú)獨(dú)有偶,基因泰克的GEN1046也被BioNTech退貨。
這條布滿荊棘的賽道中,維立志博正在艱難前行。LBL-024采用對(duì)稱分子設(shè)計(jì),核心特點(diǎn)是對(duì)PD-L1的親和力遠(yuǎn)高于4-1BB,僅在結(jié)合腫瘤細(xì)胞表面的PD-L1后才會(huì)激活4-1BB的激動(dòng)活性,以此減少其與外周血等正常組織中4-1BB的相互作用,解決4-1BB激動(dòng)劑肝毒性和治療窗口窄的挑戰(zhàn)。
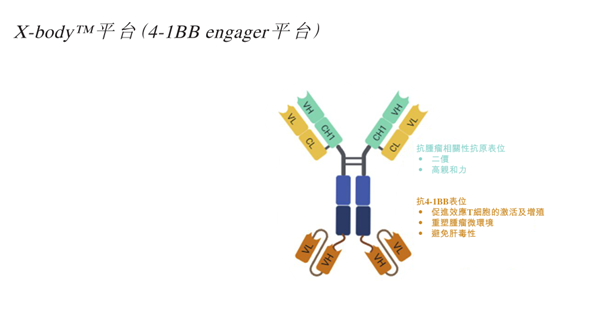
圖:LBL-024結(jié)構(gòu)圖,來(lái)源:招股書(shū)
在適應(yīng)癥的選擇上,維立志博選擇了肺外神經(jīng)內(nèi)分泌癌(EP-NEC)這一小適應(yīng)癥為切入口,以便能通過(guò)單臂臨床試驗(yàn)快速切入市場(chǎng),后續(xù)再不斷將適應(yīng)癥拓展到大癌種。
此前的研發(fā)日上,維立志博也更新了LBL-024聯(lián)合化療一線治療EP-NEC的臨床結(jié)果:52名療效可評(píng)估的患者的ORR為75.0%,DCR為92.3%。15mg/kg劑量組的ORR達(dá)83.3%,這一結(jié)果優(yōu)于目前所有的治療方案。尤其在安全性這一重點(diǎn)問(wèn)題上,入組約450名患者無(wú)一例出現(xiàn)劑量限制性毒性,三級(jí)及以上肝酶升高僅1.3%,與PD-1相當(dāng)。這也給4-1BB的成藥帶來(lái)了新的希望。
基于這一臨床數(shù)據(jù),維立志博計(jì)劃將在2026年提交LBL-024的上市申請(qǐng)。如果一切順利的話,其有望成為全球第一個(gè)上市的4-1BB激動(dòng)劑藥物,也將使4-1BB成為PD-1/L1、CTLA-4、LAG3后,全球第四個(gè)成藥的免疫檢查點(diǎn)。
不過(guò),對(duì)于PD-L1/4-1BB雙抗而言,如果不能拿下肺癌、肝癌這樣的主流戰(zhàn)場(chǎng),那么市場(chǎng)天花板將會(huì)嚴(yán)重受限。這也是維立志博正在做的,其表示針對(duì)LBL-024已布局12個(gè)適應(yīng)癥,覆蓋10大癌種。

圖:LBL-024臨床計(jì)劃,來(lái)源:公司公告
即使LBL-024成功上市,可小適應(yīng)癥的商業(yè)化前景有限,其后續(xù)仍有很長(zhǎng)的路要走。“月亮”還是兒時(shí)的圓。
二
TCE,“新的月亮”
除PD-L1雙抗外,維立志博還布局了ADC、TCE等熱門(mén)賽道。縱觀維立志博的管線布局,“不跟風(fēng)” 是最鮮明的標(biāo)簽,沒(méi)扎堆熱門(mén)靶點(diǎn),反而在多個(gè)領(lǐng)域跑到了全球前列,尤其是 TCE 平臺(tái)的兩款藥物,潛力讓人眼前一亮。
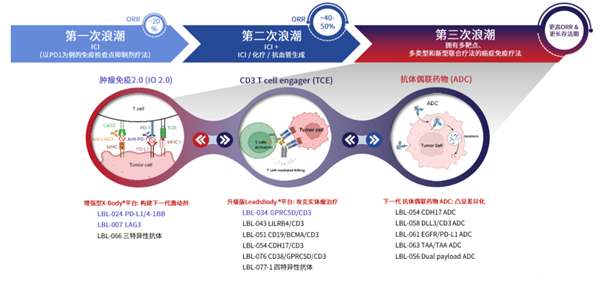
圖:維立志博管線布局,來(lái)源:公司公告
基于TCE平臺(tái),維立志博研發(fā)了GPRC5D/CD3雙抗LBL-034,其研發(fā)進(jìn)度全球第二,僅次于強(qiáng)生的塔奎妥單抗。作為GPRC5D/CD3 TCE雙抗,LBL-034的研發(fā)依托于維立志博的TCE平臺(tái)。
從現(xiàn)有的臨床數(shù)據(jù)來(lái)看,LBL-034確實(shí)有BIC的潛力。在治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤的臨床研究中,劑量為800μg/kg時(shí),ORR 90.9%,深度緩解(≥VGPR)81.8%,完全緩解/嚴(yán)格意義的完全緩解(CR/sCR)63.6%,表現(xiàn)優(yōu)于塔奎妥單抗,做出了堪比CAR-T的療效。
如果LBL-034在三期臨床中能夠穩(wěn)住這個(gè)數(shù)據(jù),意味著它能用更常規(guī)的雙抗療法,達(dá)到接近 CAR-T的療效。這背后的想象空間可不小,畢竟 CAR-T 治療成本高、門(mén)檻也高,雙抗若能實(shí)現(xiàn)類似效果,對(duì)患者和市場(chǎng)都是大突破。
維立志博的TCE平臺(tái)另一款潛在藥物是LBL-043,這是一款LILRB4/CD3雙抗,能夠重新定向T細(xì)胞對(duì)抗AML及復(fù)發(fā)性及難治性多發(fā)性骨髓瘤細(xì)胞。
不過(guò),多發(fā)性骨髓瘤領(lǐng)域可謂強(qiáng)者輩出。前面有強(qiáng)生這座大山,作為血液瘤領(lǐng)域的霸主,強(qiáng)生不僅有塔奎妥單抗,還手握達(dá)雷妥尤單抗、特立妥雙抗、西達(dá)基奧侖賽 CAR-T 等產(chǎn)品,甚至 CD3/BCMA/GPRC5D 三抗已進(jìn)入三期臨床,進(jìn)度遠(yuǎn)超維立志博。
后有信達(dá)生物緊追不舍,雖然其DLL3/CD3雙抗 IBI115 進(jìn)度落后一些,但信達(dá)推進(jìn)臨床的速度在行業(yè)內(nèi)出了名的快,隨時(shí)可能追上來(lái)。這樣的情況下,維立志博不能大意,最穩(wěn)妥的還是盡快找一個(gè)強(qiáng)大的合作伙伴,補(bǔ)全商業(yè)化和研發(fā)推進(jìn)的短板。
血液瘤之外,維立志博還把目光投向了更廣闊的實(shí)體瘤市場(chǎng),LBL-033 就是先遣隊(duì)員。這是全球第二款進(jìn)入臨床階段的MUC16/CD3雙特異性抗體,正被開(kāi)發(fā)用于治療MUC16高表達(dá)的實(shí)體瘤,尤其是卵巢癌、宮頸癌及子宮內(nèi)膜癌等婦科癌癥。目前I/II期臨床試驗(yàn)數(shù)據(jù)中已觀察到LBL-033的初步療效信號(hào)及良好的耐受性。只是具體數(shù)據(jù)還沒(méi)披露,后續(xù)表現(xiàn)值得期待。
總體來(lái)看,維立志博的管線并不是跟風(fēng)湊數(shù),而是真的在某些領(lǐng)域跑到了全球前面,但走一條少有人走的路必然要承擔(dān)更大風(fēng)險(xiǎn)。全球領(lǐng)先的進(jìn)度意味著沒(méi)有太多先例可參考,臨床推進(jìn)、療效驗(yàn)證都要自己摸索。這樣的情況下,維立志博想把潛力變成實(shí)力還有不少難關(guān)要闖。
三
市場(chǎng)終歸需要“六便士”
從創(chuàng)立至今,維立志博始終保持一顆追逐“月亮”的心,時(shí)至今日依然未變。
在研發(fā)日上,維立志博透露,公司的目標(biāo)是到2030年推出3款商業(yè)化產(chǎn)品,4-8款臨床后期產(chǎn)品,5個(gè)產(chǎn)品進(jìn)入全球多中心臨床,其中至少2款產(chǎn)品推進(jìn)至全球多中心III期注冊(cè)研究。
以潛力而論,維立志博的產(chǎn)品從不需要投資者擔(dān)心,但能否順利落地又是另外一個(gè)問(wèn)題了。尤其是真正的“燒錢(qián)”時(shí)刻才剛剛到來(lái),維立志博即將迎來(lái)現(xiàn)金流“大考”。
維立志博已經(jīng)開(kāi)始給核心產(chǎn)品 LBL-024拓展能力圈,在非小細(xì)胞肺癌、膽道癌、肝細(xì)胞癌等大適應(yīng)癥上全面鋪開(kāi)臨床。研發(fā)開(kāi)支自然水漲船高,上半年公司研發(fā)投入1.32億元,同比增長(zhǎng)56.92%。好在,港股成功上市為維立志博送來(lái)了“及時(shí)雨”。截至8月份,公司持有現(xiàn)金加上IPO募資凈額,合計(jì)約16億元,暫時(shí)能抗住眼前的研發(fā)壓力。
事實(shí)上,維立志博在“找錢(qián)”這件事上一直很懂節(jié)奏:2021年市場(chǎng)轉(zhuǎn)折前,果斷將C輪融資額翻倍;今年趁市場(chǎng)回暖,又將IPO募資額大幅提升近一倍至1.89億美元。正是這幾次關(guān)鍵決策,幫它穩(wěn)穩(wěn)熬過(guò)了行業(yè)周期。
不過(guò),16億想撐住十幾款新藥的長(zhǎng)期開(kāi)發(fā),公司面對(duì)的未來(lái)資金壓力不容小覷。光靠資本市場(chǎng)輸血遠(yuǎn)遠(yuǎn)不夠,“抱緊大腿”通過(guò)BD合作獲取資源與現(xiàn)金流,幾乎是一條必由之路。
今年10月,在國(guó)產(chǎn)創(chuàng)新藥BD大潮中,維立志博也身在其中,與美國(guó)藥企Dianthus 簽署就LBL-047開(kāi)展合作。這次BD金額拿到臺(tái)面上來(lái)說(shuō)的確不算大,首付款及近期里程碑付款最高3800萬(wàn)美元約合2.7億元,但至少可以覆蓋掉維立志博一年的研發(fā)費(fèi)用。
總體而言,維立志博能被資本市場(chǎng)超3000倍認(rèn)購(gòu),說(shuō)明大家還是認(rèn)它的技術(shù)潛力。可醫(yī)藥行業(yè)終究要回歸“臨床效果好不好、能不能賣(mài)出去”的硬檢驗(yàn),這對(duì)熬了13年才上市的維立志博來(lái)說(shuō),才是關(guān)鍵一役。
企業(yè)可以堅(jiān)守“月亮”,但市場(chǎng)終歸需要“六便士”。
編者按:本文轉(zhuǎn)載自微信公眾號(hào):醫(yī)曜,作者:陳晨

前瞻經(jīng)濟(jì)學(xué)人
專注于中國(guó)各行業(yè)市場(chǎng)分析、未來(lái)發(fā)展趨勢(shì)等。掃一掃立即關(guān)注。




























